可逆反应N2(g)+3H2(g) 2NH3(g),△H
2NH3(g),△H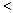 0,达到平衡后,为了使H2的转化率增大,下列选项中采用的三种方法都正确的是( )
0,达到平衡后,为了使H2的转化率增大,下列选项中采用的三种方法都正确的是( )
- A.升高温度,降低压强,增加氨气
- B.降低温度,增大压强,加入催化剂
- C.升高温度,增大压强,增加氨气
- D.降低温度,增大压强,分离出部分氨
答案
正确答案:D
知识点:合成氨条件的选择
要使H2的转化率增大,则要使化学平衡正向移动。首先分析温度对化学平衡的影响,合成氨是放热反应,因此降低温度会使平衡正向移动,选项A、C中升高温度是错误的,可先排除。再分析压强对化学平衡的影响,合成氨反应是气态物质系数减小的反应,所以增大压强会使平衡正向移动,选项B、D都符合。加入催化剂可加速反应的进行,但对平衡移动无影响,选项B错误。分离出部分氨,即减小生成物浓度,会使平衡正向移动,选项D正确。
故选D。
略







